1.Твердые
растворы. Влияние состава на свойства растворов. Факторы, влияющие на
растворимость. Упорядоченные твердые растворы.
Твердые растворы - фазы
переменного состава, в которых атомы различных элементов расположены в общей
кристаллической решетке.
Твердый раствор внедрения Твердый
раствор замещения


Обозначение: А(В) – твердый раствор элемента В в кристаллической решетке элемента А.
При образовании твердых растворов возникают упругие искажения кристаллической решетки растворителя (в твердых растворах внедрения больше, что вызывает изменения свойств).
Влияние состава на свойства растворов
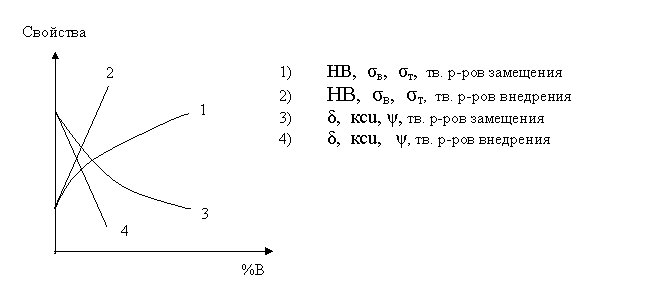
Факторы, влияющие на растворимость
1.Растворимость уменьшается при увеличении разницы размеров атомов растворителя и растворимого элемента: чем меньше разница, тем больше растворимость. Это – размерный фактор.
2.Растворимость зависит от характера связывающих орбиталей в кристаллической решетке элементов. По этому критерию все элементы можно разбить на 4 группы:
I группа (класс) IA; IIA; IB; IIB; IIIB (кроме В).
Внешние электроны в S или Р состояниях. Благоприятные условия получения sp-связей. Преобладает функция s-типа, а в элементах подгруппы В – р-типа.
II класс – d-переходные элементы (металлы), в которых имеются условия образования Sd и Spd-гибридных орбиталей. d-функция максимальна в середине каждой последовательности.
III класс
IV класс: IVB, VB, VIB, VIIB группы – здесь имеются условия для образования октетов за счет ковалентной или ионной связей.
Общий закон: элементы с разным типом связывающих орбиталей разных классов плохо растворяются друг в друге.
3.В пределах одного класса растворимость уменьшается с увеличением разницы валентностей.
4.Еще одно правило: если в системе А и В образуется промежуточная фаза - растворимость уменьшается.
5.В некоторых случаях (например, в твердых растворах на основе Cu) предельная растворимость определяется предельной электронной концентрацией (е/n≤1,36). Этот факт объясняется с позиций зонной структуры.
При выполнении следующих условий возможна неограниченная растворимость.
1)Элементы одного класса, точнее – с одинаковым типом связывающих орбиталей.
2)Элементы имеют близкие размеры (Δr<0,15).
3)Элементы имеют одинаковую кристаллическую решетку.
Упорядоченные твердые растворы
Полностью упорядоченные твёрдые растворы принято называть сверхструктурными. В некоторых случаях в твёрдые растворы атомы одного сорта могут стремиться к объединению, образуя скопления, которые, в свою очередь, могут определённым образом ориентироваться или упорядоченно распределяться. Экспериментальные данные об упорядочении твёрдые растворы получают в основном при изучении диффузного рассеяния рентгеновских лучей. Сверхструктуры возникают на базе фаз с кубической или гексагональной решеткой вблизи составов А3В АВ АВ3. Образование сверхструктур обеспечивает, с одной стороны максимальное число разноименных связей А – В, а с другой – уменьшение энергии электронов проводимости на уровне поверхности Ферми с границами зон Бриллюэна.
2.
Промежуточные фазы, их виды, особенности строения, факторы, управляющие их
образованием.
Промежуточными фазами называются такие фазы сплавов, кристаллическая решетка которых отличается от кристаллических решеток элементов, входящих в их состав.
Факторы, управляющие их образованием
1)Закон валентностей
2)Геометрические факторы
3)Фактор электронной концентрации – фактор зонной структуры
Рассмотренные факторы – далеко не единственные и не объясняют удивительного многообразия промежуточных фаз.
Промежуточные
фазы, подчиняющиеся закону валентности
К ним относятся хорошо известные всем кристаллические вещества и ионным типом связи: Al2O3; Fe3O4; NaCl, Mg2Si и т.д. Такие фазы имеют (почти) постоянный состав, хотя и среди них встречаются фазы с заметной областью гомогенности. Например – структуры вычитания, к которым относится вюстит FeO. В действительности этот оксид железа содержит всегда меньше атомов Fe, чем это требуется формулой, за счет вакантных узлов кристаллической решетки, в которых должны располагаться атомы Fe (точнее ионы).
Промежуточные
фазы, образование которых управляется геометрическими факторами.
В отсутствии других факторов образование промежуточных фаз управляется геометрическими факторами, а именно:
Промежуточная фаза устойчива, если ее кристаллическая структура обеспечивает наиболее полное использование пространства (наибольшую плотность), наличие структурных связок наибольшей мерности, наибольшую симметрию решетки.
а) Фазы Лавеса
Типичные представители таких фаз, отвечающих формуле АВ2 причем Da/Db≈1,225. Их кристаллические решетки для данного соотношения размеров обеспечивают наибольшую плотность и наибольшие координационные числа. Таких фаз – более 300 и они относятся к трем структурным типам.
Чередование плотноупакованных слоев ABCABCABC
Чередование плотноупакованных слоев АВАВАВ
Чередование плотноупакованных слоев АВАСАВАС
б) Фазы внедрения
Образуются при образовании элементов малого размера (H,N,C,O,B) с переходными металлами, если Rнм/Rме<0,59. Их кристаллические решетки – ГЦК или ГПЦ, образованные металлическими атомами, а атомы неметалла находятся в порах этих решеток.
Состав определяется простыми формулами МеХ, Ме2Х, Ме 4Х, где Х – атом неметалла. Формула, приписываемая фазе внедрения, соответствует максимальному содержанию атомов неметалла.
Электронные
соединения.
Электронными соединениями называются соединения, кристаллические решетки которых определяются электронной концентрацией и объясняются с позиций зонной структуры.
Образуются при взаимодействии металлов IA или IB или переходных металлов с одной стороны с простыми элементами II – V групп системы элементов.
Наиболее многочисленные из них – фазы Юм – Розери.
Электронные соединения (фазы Юм-Розери) представляют собой промежуточные фазы из двух металлов, мало различающихся по величине атомного диаметра, причем один из них является одновалентным или переходным, а другой простым металлом с валентностью от 2 до 5. Переходным металлом в различных случаях приписывается валентность от 0 до 2. Эти соединения согласно Юм-Розери, характеризуются постоянным отношением общего числа валентных электронов (е) к общему числу атомов (n). Различные соединения имеют однотипные решетки, если отношение с:п одинаково.
Найдены три повторяющиеся во многих системах электронные концентрации, а именно: 3:2, 21:13, 7:4. При е \ п= 3:2 образуется фаза бета с решеткой трех типов — объемно-центрированной кубической, сложной кубической и плотноупакованной гексагональной, При е\п=21 : 13 образуется фаза гамма с решеткой, имеющей 52 атома в ячейке, и при е: п=7 : 4 — эпсилон-фаза с плотноискаженной гексагональной решеткой.
3. Карбидные
фазы легированных сталей, их влияние на свойства.
Легирующие элементы делятся на
карбидообразующие и не карбидообразующие.
Согласно теоретическим представлениям карбидные (и нитридные) фазы могут образовывать лишь переходные элементы, причем способность к карбидообразованию тем больше, чем менее заполнены d или f оболочки.
Например, в четвертом периоде склонность к карбидообразованию уменьшается с увеличением номера группы
Sc Ti V Cr Mn Fe Co Ni
В пятом периоде – склонность к карбидообразованию уменьшается в ряду
Y
В сталях Co и Ni не образуют карбидов, хотя в кобальтовых и никелевых сплавах могут быть карбиды цементитного типа Ni3C иCo3C.
В титановых сплавах нет карбидов V,Cr и т.д., но возможно появление карбида циркония.
В малолегированных сталях основной карбид – цементит Fe3 C, в котором растворяются:
Mn-сколько угодно, Cr-до 15%, V-до 10%, Mo-до2% (закономерность, чем больше склонность к карбидообразованию, тем меньше этого элемента растворяется в цементите). Структура цементита легированного и нелегированного - орторомбическая.
В сталях с высоким содержанием хрома возможны карбиды типа Me7C3 с тригональной решеткой ( например, Cr7C3; (Cr,Fe)7C3; (Cr,Mn)7C3; (Cr,V)7C3), и карбиды типа Me23C6 (Cr23C6, Fe21 Mo2C6, Fe21 W2C6 и т.д.) со сложной кубической решеткой.
Сильные карбидообразующие элементы - Ti, Zr, Nb, Tc - образуют карбиды, представляющие собой фазы внедрения - TiC, ZrC, VC, HfC, TaC с кубической решеткой. Некоторые из них имеют значительные области гомогенности. Например, карбид титана может иметь состав от Ti2C до TiC, карбид ванадия может иметь состав от V4C3 до VC и т.д.
В сложнолегированных сталях с высоким содержанием W и Mo появляется карбид типа Me6 C со сложной кубической решеткой: Fe3 Mo3 C и Fe2 W4 C. Фазы внедрения типа VC или TiC растворяются в аустените лишь при высоких температурах, сдерживая рост аустенитного зерна (часто – основная цель их введения в сталь).
Формирование
карбидной фазы обусловливает высокую сопротивляемость хрупким разрушениям,
размельчение зернистой структуры, увеличение прочности вследствие торможения
дислокаций, увеличение температуры плавления сплава.
4.
Закономерности первичной кристаллизации. Влияние степени переохлаждения на
скорость кристаллизации и размер первичных кристаллов. Модифицирование.
Процесс образования кристаллов из расплавов, растворов, паровых фаз называется первичной кристаллизацией или просто кристаллизацией.
Закономерности роста кристаллов – зарождение центров кристаллизации, течение этих процессов и размеры образовавшихся кристаллов зависят от степени переохлаждения.
Зарождение центров кристаллизации бывает гомогенным и гетерогенным.
Гомогенным называется зарождение в случайных местах однородной жидкости.
|
t T Тр Тк Δ
T DT Tk Tp GV
ж GVK T DGV Gv |
Tp – температура равновесия, “теоретическая” температура плавления (кристаллизации): при Tp при охлаждении кристаллизация не может идти - нет движущегося стимула кристаллизации - DGn. DGn - изменение энергии Гиббса единицы объема вещества при переходе его из расплава в кристаллическое состояние. DT - степень переохлаждения. при Tp: DGn = DH-TpDS = 0 ® DS = DH/Tp; DH = L – тепловой эффект кристаллизации. при Tk: DGn = DH - TDH/Tp = LDT/Tp; Tk – действительная температура кристаллизации |
Однако, при образовании кристалла объемом V изменение энергии системы не будет равно DGn*V, т.к. появляется поверхность раздела кристалл-жидкость, на образование которой требуется затратить энергию.
Общее изменение энергии при образовании кристаллика радиусом r в предположении, что поверхностная энергия не зависит от кристаллографической ориентировки поверхности раздела и температуры кристаллизации, имеем:
|
rкр Aкр Δ
G r |
DG = -DGn*V + s*S = -4/3pr³*DGn
+ 4pr²s (d(ΔG)/dr)при r= r крит =0 rкр=
2s/DGn
= 2s Tp /(LDT) Акр – энергетический барьер процесса самопроизвольной гомогенной кристаллизации. |
Aкр = 4/3r²крs /3 - 1/3 поверхностной энергии кристалла. Этот энергетический барьер преодолевается за счет флуктуации энергии в жидкости.
Теперь уточним понятие центра кристаллизации ц.к. – это объем в жидкой фазе с упорядоченным расположением атомов, характерным для кристалла, достигший критического размера, рост которого приводит к уменьшению энергии системы. Видно, что вероятность возникновения ц.к. исключительно быстро увеличивается с ростом степени переохлаждения DT.
Однако, при очень больших DT (т.е. при низких температурах) на первый план может выйти другой, кинетический, фактор: образование ц.к. и их рост связаны с подвижностью атомов и их возможностью перехода границу раздела “жидкость-кристалл”.
для широкого диапазона степеней переохлаждения:
DT ® n ® r* ®¯rкр
Этот вывод, полученный для случая гомогенной кристаллизации, оказывается справедливым для многих реально происходящих процессов кристаллизации.
Гетерогенное зарождение - это зарождение кристаллов на готовых поверхностях – стенках изложницы, твердые частицы примесей и т.д.
 Если
между кристаллом (растущим) и подложкой наблюдается структурное и размерное
соответствие, то образование кристаллов облегчается и на практике почти всегда
наблюдается именно гетерогенное зарождение.
Если
между кристаллом (растущим) и подложкой наблюдается структурное и размерное
соответствие, то образование кристаллов облегчается и на практике почти всегда
наблюдается именно гетерогенное зарождение.
J - угол “смачивания” подложки кристаллом.
sжп - sкп = sжк cosJ
Элементарный расчет показывает, что энергетический барьер А*кр связан с энергетическим барьером Акр гомогенного зарождения соотношением
A*кр = Акр 1/4(2+cosJ)(1-cosJ)²
при J = 0 – его нет – просто растет кристалл-подложка
при J »180° – кристалл не чувствует подложки.
Для размельчения зерна литых металлов и сплавов проводят процесс модифицирования, т.е. введение веществ – модификаторов в малых количествах, приводящее к резкому размельчению зерна. Модификаторы – это или готовые центры кристаллизации или вещества, снижающие поверхностное натяжение s на границе жидкость-кристалл.
5. Факторы, определяющие форму и размер первичных кристаллов.
В условиях, далеких от равновесия форма и размер образующихся кристаллов зависит от многих факторов.
1. Фактор межатомной связи и фактор ее анизотропии.
2. Механизмы роста кристаллов.
3. Степень переохлаждения.
4. Температурные градиенты (дендритный или нет будет кристалл)
5. Химический состав расплава (наличие модификаторов, карбидов и тд)
Кристалл- это анизотропное тело. В частности, поверхностное натяжение различно для различных кристаллографических плоскостей. Поэтому сферическая форма при данном объеме не будет соответствовать минимуму поверхностной энергии:
U = ΣSi *σi = min
Термодинамическая теория (Гиббс, Кюри) гласит, что в процессе роста кристалл стремится принять форму, которая характеризуется минимумом поверхностной энергии:
Это положение приводит к тому, что ( Г.В. Вульф) соблюдается соотношение
σ1/r =σ2/r = const
r -расстояние от центра кристалла.
Кстати, это приводит к тому, что быстро растущие грани зарастают, а остаются медленно растущие с малым поверхностным натяжением.
Равновесная форма кристаллов возможна при очень больших выдержках в условиях близких к равновесным.
Нормальный механизм роста предопределяет округлые формы растущих кристаллов. Тангенциальный механизм роста предопределяет ограненные формы кристаллов.
Чем выше степень переохлаждения, тем более мелкие кристаллы будут образовываться.
На форму поверхностей первичных
кристаллов влияет v охл : с увеличением скорости
охлаждения кристаллы с плоскими гранями сменяются окружными
Рассмотрение механизмов роста
позволяет понять переход от компактной формы к
разветвленной.
Наиболее подходящее место
образования двумерного зародыша - ребро кристалла:
когда слои роста перестают
полностью покрывать грань пирамид нарастания, появляются боковые отростки,
превращая компактный кристалл в разветвленный.
Ребра имеют преимущества в
скорости нарастания по нескольким причинам:
а) лучшие условия отвода тепла;
б) ребро- набор
кристаллографических плоскостей.
Выводы:
1. Размер первичных кристаллов тем мельче, чем больше степень переохлаждения.
2. Ограненная форма кристаллов характерна для кристаллов с послойным механизмом роста и малой степенью переохлаждения.
3. Увеличение скорости охлаждения способствует увеличению разветвленности кристаллов и переходу к округлой их форме.
4. Кристаллы вытянуты в направлении теплоотвода.
5. Монокристаллы можно получить при гетерогенной кристаллизации, создавая условия роста только одного готового затравочного кристалла.
6. Аморфные металлы можно получить при сверхбыстром охлаждении, когда ЧЦК=0 и D=0/ (104 …106 0C/c)
7.Форма первичных кристаллов может изменяться в присутствии примесей или модификаторов, которые селективно адсорбируются на определенных кристаллографических плоскостях, меняя скорость их роста.